Ключевые слова
Атопический дерматит • Осмолиты • Эктоин • Местное применение
Выдержка
Введение:
Природный циклический тетрагидропиримидин эктоин представляет собой низкомолекулярный органический осмолит, способный связывать воду. Ранее было продемонстрировано, что местное применение эктоина на здоровой коже ведет к улучшению гидрации кожи и укреплению барьерной функции.
Цели: Мы сделали предположение, что эктоин может оказаться полезным при местной терапии атопического дерматита (АД), заболевания, при котором существенный аспект патогенеза связан с генетически-обусловленным дефектом кожного барьера. Мы оценили эффективность крема на основе эктоина (EHK02-01) при терапии 65 пациентов с легким до умеренного АД в ходе рандомизированного, интраиндивидуального, двойного слепого многоцентрового исследования. В рамках исследования эктоин сравнивали с нестероидным противовоспалительным кремом, который, как выяснилось ранее, способен укреплять барьерную функцию кожи (следовательно, обладает схожим действием).
Методы: В исследовании приняли участие 65 пациентов с легким до умеренного АД в возрасте 18-65 лет. Пациенты наносили крем EHK02-01 и контрольный крем на два симметричных участка кожи в течение 28 дней. В начале исследования, через 7 и 28 дней терапии изучаемые участки оценивали при помощи модифицированной местной объективной шкалы SCORAD (балл атопического дерматита) и шкале IGA (общая оценка исследователя). Также учитывали оценку пациентов в отношении эффективности терапии и интенсивности зуда.
Результаты: EHK02-01 переносился очень хорошо. Что еще более важно, эффективность EHK02- 01 была сопоставима с эффективностью средства сравнения. Заключение: Полученные результаты позволяют предположить, что EHK02-01 потенциально может представлять собой новое средство терапии АД.
Авторское право© 2013 С. Каргер АГ, Базель
Введение
Атопический дерматит (АД) представляет собой воспалительное заболевание кожи, сопровождающееся сильным зудом. Эффективная радикальная терапия в данный момент отсутствует. Контроль заболевания ограничивается исключительно симптоматической терапией. Согласно актуальным представлениям, патогенез АД обусловлен сочетанием генетически обусловленных дефектов барьерной функции кожи и нарушений в работе врожденного иммунитета, а также аномальной иммунологической реакцией на аллергены и антигены. Меры по контролю АД зависят от тяжести заболевания и могут включать в себя гидрацию кожи, укрепление барьерной функции кожи, фармакологическую терапия, выявление и исключение факторов воспалительного процесса (например, аллергенов и раздражителей). Для пациентов с АД характерно снижение барьерной функции кожи и сухость кожи, поэтому неотъемлемой частью любой симптоматической терапии хронического АД является применение умягчающих (увлажняющих) средств [1]. Несмотря на явную выгоду для пациента, применение умягчающих средств редко приводит к полному
устранению поражений кожи, особенно — в тяжелых случаях. Так, при терапии АД умеренной- тяжелой степени для контроля обострений зачастую приходится прибегать к иммуномодулирующим и противовоспалительным средствам. С самого момента появления, местные кортикостероиды заняли одно из ключевых мест в противовоспалительной терапии АД [2]. Позже появилась альтернатива — ингибиторы кальциневрина для местного применения. Средства этого класса обладают целевым противовоспалительным действием, но при этом, в отличие от местных кортикостероидов, не вызывают нежелательных местных или системных явлений [3-5]. Несмотря на эффективность кортикостероидов и ингибиторов кальциневрина, длительное применение средств этих классов ограничено нежелательными побочными явлениями [см. 6], что наталкивает на мысли о необходимости альтернативным средств терапии. В данном контексте мы, и некоторые другие исследователи, получили обнадеживающие данные, свидетельствующие о том, что такой альтернативой может стать натуральный осмолит эктоин. Эктоин представляет собой низкомолекулярный органический осмолит, циклический тетрагидропиримидин. Впервые вещество было обнаружено Галински и соавторами [7] в галобактериях Ectothiorhodospira halochloris, а затем и во многих других галофильных и галотолерантных бактериях. Экстремофильные микроорганизмы обладают высокой защищенностью от внешних факторов стресса. Для защиты такие микроорганизмы вырабатывают специальные молекулы, т. н. экстремолиты. Эктоин характеризуется высокой совместимостью и является одним из наиболее полно изученных экстремолитов. У бактерий, экстремолиты выступают в качестве осмопротекторов и стабилизируют клетки и биологические молекулы [7, 8] в экстремальных ситуациях, включая осмотический стресс, нагрев и дессикацию [9]. Были предприняты попытки использовать свойства эктоина для защиты человеческой кожи — эктоин используется в косметической отрасли уже более 10 лет [10].
Исследования подтверждают, что эктоин оказывает на кожу человека благоприятное влияние [11, 12]. В частности, косметические эмульсии на основе эктоина защищали кожу от потери влаги и продлевали период между нанесением увлажняющих средств [10]. Наша цель — изучить действие крема на основе эктоина (EHK02-01) при местном применении in vivo у пациентов с легким до умеренного АД. Для этого мы провели исследование, в ходе которого сравнивали эффективность EHK02-01 с эффективностью средства MAS063DP (Атопиклер™). MAS063DP является первым медицинским изделием, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) как средство облегчения симптомов (зуд, жжение, боль) АД и аллергического контактного дерматита [13]. Предполагается, что механизм действия средства связан с укреплением барьерной функции кожи. Эффективность и безопасность средства при легком до умеренного АД подтверждена рядом клинических исследований [14-18]. В связи с этим вы использовали данное средство в качестве препарата сравнения. В контексте данного исследования MAS063DP будет считаться положительным контролем.
Материалы и методы
Материалы
EHK02-01 и контрольное средство предоставлены битоп АГ, Виттен, Германия, в идентичных контейнерах (для обеспечения слепого метода исследования). На маркировке каждого контейнера был указан номер участника исследования. Пациенты, наблюдатели и персонал исследования не знали, какое средство находится в том или ином контейнере. В состав EHK02-01 входят следующие компоненты: эктоин, вода, гидрогенизированный лецитин, керамид-3, сквалан, оливковое масло, каприловый / каприевый триглицерид, масло каритэ, рисовый воск (получен из Oryza sativa), карбомер, ксантановая камедь, желатин, экстракт цветков / листьев / лозы кардиоспермума халикакабского, глицин, аланин, пентиленгликоль, бутиленгликоль, гидроксиэтилцеллюлоза, глицерин, гидроксифенил, пропамидобензойная кислота. В состав положительного контроля входят следующие компоненты: вода, этилгексилпальмитат, масло каритэ, пентиленгликоль, арахидиловый спирт, бегениловый спирт, арахидилглюкозид, глицерилстеарат, стеарат PEG-100, бутиленгликоль, глицирретиновая кислота, каприлоилглицин, бисаболол, токоферола ацетат, карбомер, этилгексилглицерин, пироктоналамин, натрия гидроксид, аллантоин, ДМДМ гидантоин, виноград, гиалуронат натрия, двунатриевая ЭДТК, аскорбилтетраизопальмитат, пропилгаллат и телместеин.
Пациенты
В исследовании могли принять участие мужчины и женщины в возрасте 18-65 лет с АД в активной стадии (IGA 1 — 4), диагностированном за 6 и более месяцев до исследования. На теле пациента должно было быть не менее двух симметрично билатерально расположенных пораженных участка кожи, площадью не менее 10 см² каждый. Объективный местный балл атопического дерматита (SCORAD) для каждого участка должен составлять >5. Разница в балле по шкале SCORAD между двумя пораженными участками не должна превышать 3. В исследование допускались пациенты, чье состояние по итогам медицинского осмотра и анализа анамнеза оценивали как удовлетворительное. Пациентов не допускали к исследованию, если обнаруживали у них признаки заболевания кожи или любого другого заболевания, которое, по мнению исследователя, могло оказать затронуть цели исследования или повлиять на безопасность пациентов. Обязательным условием участия в исследовании для женщин и девушек был отрицательный результат теста на беременность на базовом уровне. Участницы исследования обязались использовать надежные меры контрацепции на всем протяжении исследования. Пациенты не могли принять участие в исследовании, если принимали определенные лекарственные средства в течение установленного срока до исследования (и обязаны были отказаться от приема таких средств во время исследования и в течение установленного срока после исследования): местные ингибиторы кальциневрина, кортикостероиды, антибиотики (2 недели), системные антигистаминные средства (2 недели), средства биологического происхождения (6 месяцев), кортикостероиды, антибиотики, иммуносупрессорные средства, УФ- терапия (4 недели). Добровольцев в исследование набирали в Германии (Потсдам, Фрейбург, Берлин и Малов) из числа пациентов дерматологических клиник. От независимого и надлежащим образом составленного комитета по этике в г. Фрейбург было получено разрешение на проведение исследование. Исследование проводили в соответствии с этическими нормами, установленными Хельсинской декларацией, указаниями по Надлежащей практике проведения клинических исследований Международной конференции по гармонизации (CPMP/ICH/135/95) и требованиями ISO 14155. Клиническое исследование проведено в соответствии с требованиями закона Германии «О медицинских изделиях» (MPG § 20-22) и зарегистрировано на сайте Clinicaltrials.gov (рег. № NCT01079897). Перед участием в исследовании все пациенты дали письменное информированное согласие.
Рандомизация и терапия
Критерии включения и исключения проверяли во время визита 2 (V2) в день 0, пациентов рандомизировали в две группы в соответствии со списком рандомизации (группа A: левая сторона = EHK02-01, правая сторона = положительный контроль; группа B: левая сторона = положительный контроль, правая сторона = EHK02-01). Код рандомизации и запечатанные конверты с информацией о терапии для экстренных случаев заполнялись биометристом, который, помимо выполнения указанных операций, не участвовал в исследовании. Рандомизацию выполняли поблочно на основе внутреннего стандарта рандомизации, гарантирующего сбалансированное распределение пациентов по группам в пределах центра исследования. Размер блоков не указан в протоколе исследования и неизвестен исследователям. Был создан перечень условных номеров пациентов (1-120). Для каждого номера пациента генерировали случайное число в диапазоне 0 — 0,99) при помощи соответствующей функции таблицы Excel (RAND). Если сгенерированное число было больше 0,5, пациента распределяли в группу А, в противном случае — в группе B. Половина блоков была заполнена автоматически (комплементарно по отношению к первой половине блоков), чтобы гарантировать равномерное распределение групп терапии. Перед началом терапии изучаемые участки кожи на каждой стороне тела отмечали специальным маркером. Пациенты наносили испытуемые средства самостоятельно, 2 р/сут (утром и вечером) с дня 0 (V2) по день 28 (V4). Средства наносили и на левую, и на правую конечность. В течение исследования пациентам не разрешалось наносить другие лекарственные или косметические средства на изучаемые участки. Пациентам разрешалось применять умягчающие средства и местные кортикостероиды класса I или II для терапии других участков АД, составляющих не более 10% поверхности тела.
Дизайн исследования
Дизайн исследования представлен на рисунке 1. Во время первого визита были собраны демографические данные и проведен медосмотр, включающий в себя оценку общего состояния, измерение роста, веса, температуры, артериального давления и частоты сердцебиения. Клиническое исследование подразумевало 2 периода и 4 визита. После истечения периода 1 (период вымывания — 28 дней), все добровольцы получили испытуемые средства. Изучаемые пораженные участки оценивали перед началом терапии, а затем — в день 7 и день 28 (см. описание ниже).
Эффективность
Первичная цель исследования — изучить эффективность EHK02-01, определяемую как изменение модифицированного объективного местного балла SCORAD [19, 20] изучаемых участков кожи в период с V2 по V4. Баллы изучаемого участка по 5 клиническим параметрам (эритема, отек/папулы, кровоточивость/струпья, экскориация и лихенификация) суммировали, в результате чего получали общий балл в диапазоне 0-15 (см. таблицу 1). Балл SCORAD для каждого изучаемого участка кожи рассчитывали во время V2, V3 и V4. Вторичная цель исследования — оценить изменения в изучаемых участках по общей оценке исследователя, оценке эффективности пациентом и оценке интенсивности зуда пациентом через 7 и 28 дней исследования, а также — оценить изменения балла SCORAD через 7 дней исследования. Общая оценка исследователя (IGA) учитывает тяжесть симптомов при помощи системы, описанной в таблице 2. Данная оценка описывает состояние всей кожи (общая IGA) и тяжесть симптомов на изучаемых участках кожи (местная IGA). Пациенты оценивали испытуемые средства и их переносимость (например, ощущения жжения, покалывания, стянутости кожи) во время V3 и V4 при помощи 4-бальной шкалы (1 = лечение не помогло, 2 = немного помогло, 3 = хорошо, 4 = очень хорошо) (таблица 3). Интенсивность зуда в обоих изучаемых участках кожи оценивали во время V2, V3 и V4 при помощи визуальной аналоговой шкалы 0 — 10 см (0 = зуд отсутствует, 10 = максимально возможный зуд). Оценку проводил квалифицированный дерматолог.
Оценка безопасности
Безопасность оценивали на базовом уровне и во время V4 путем измерения основных показателей жизнедеятельности, медосмотра, опроса пациентов, оценки тяжести АД, природы и частоты нежелательных явлений (НЯ), а также их потенциальной связи с испытуемыми средствами.
Статистический анализ
Учитывая эксплораторный характер исследования, формальный расчет размера выборки не проводили. Общее число рандомизированных пациентов (60 человек) оценили как достаточное для ответа на поставленные в протоколе вопросы. Был выполнен подтверждающий анализ первичного показателя эффективности. Анализ вторичных показателей носил описательный / эксплораторный характер (если при выполнении нескольких экспериментов уровень значимости α не корректировали, то использовали α = 0,05). Для сравнения наблюдений использовали асимптотический критерий не меньшей эффективности Уилкоксона для 2 зависимых выборок как описано Веллек [21]. Предел не меньшей эффективности установили на уровне 10%. Такое значение выбрано по результатам статистического анализа ранее опубликованных исследований, в которых демонстрировалось клиническое превосходство положительного контроля над плацебо. При этом предел все же остается достаточно небольшим, чтобы можно было говорить о сопоставимой эффективности EHK02-01 при выполнении критериев.
Результаты
Совокупно в исследование было рандомизировано 65 пациентов. 4 пациента (6,2%) вышли из исследования во время V3 в связи с причинами, не связанными с терапией. Существенные нарушения протокола выявлены к 11 пациентов. Таким образом, выборка ITT для оценки безопасности составила 65 пациентов, в то время как количество пациентов, успешно завершивших исследование с выполнением требований протокола (выборка PP), составило 54 пациента.
Диаграмма участников исследования представлена на рисунке 2. Демографические характеристики и показатели на базовом уровне у пациентов обеих групп были схожими. Возраст пациентов варьировался от 18.20 до 61.90 лет, средний возраст 33,27 ± 12,76 лет (СКО); распределение по полу: 46,15% мужчин и 53,85% женщин. Все пациенты относились к европеоидной расе и имели АД в активной фазе с балом IGA 1 — 4, т. е. «практически отсутствует», «легкая степень», «умеренная степень», «тяжелая степень»: у 26,15% пациентов балл IGA соответствовал легким симптомам, у 67,69% — умеренным, у 6,15% — тяжелым. Средний размер участка для нанесения EHK02-01 составил 62,52 ± 50,18 см2, (от 12 до 247 см2 во время V2); для нанесения положительного контроля — 58,64 ± 46,57 см2 (от 11,30 до 40,60 см2) (таблица 4). Средний расход EHK02-01 составил 20,00 ± 13,61 мг/сут/см2 в период между V2 и V3 и 16,88 ± 14,74 мг/сут/см 2 в период между V3 и V4. Средний расход положительного контроля составил 20,24 ± 14,09 мг/сут/см2 в период между V2 и V3 и 16,75 ± 12,85 мг/сут/см2 в период между V3 и V4. Расход меньше 4 мг/сут/см2 считался существенным нарушением протокола (такие пациенты исключались из выборки PP).
Эффективность
На базовом уровне сумма баллов SCORAD в двух группах терапии была сопоставимой (критерий Уилкоксона: p = 0,5480). Как показано на рисунке 3, при применении EHK02-01 среднее суммы баллов SCORAD снизилось с 7,51 ± 1,76 на базовом уровне до 5,32 ± 2,49 во время V3 (критерий Уилкоксона при сравнении V2 и V3: p < 0,0001) и до 3,77 ± 3,01 ко времени заключительного визита (критерий Уилкоксона при сравнении V2 и V4: p < 0,0001). При применении положительного контроля среднее суммы баллов SCORAD снизилось с 7,55 ±1,91 на базовом уровне до 5,74 ± 2,36 во время V3 (критерий Уилкоксона при сравнении V2 и V3: p < 0,0001) и до 4,45 ± 2,88 ко времени заключительного визита (критерий Уилкоксона при сравнении V2 и V4: p < 0,0001). Существенных различий между средними значениями балла SCORAD в двух группах терапии не наблюдали: критерий Уилкоксона при сравнении показателей EHK02-01 и положительного контроля за период V2 — V3 составил p = 0,1153;) критерий Уилкоксона при сравнении показателей EHK02-01 и положительного контроля за период V2 — V4 составил p = 0,0916). Для модифицированного критерия Уилкоксона смещения распределения при применении положительного контроля было следующим: поскольку медиана разности между V2 и V3 составила -2, смещение составило -2*0,1, таким образом среднее смещение суммы баллов SCORAD составило -1,62 ± 1,78. Аналогичным образом, медиана разности между V2 и V4 составила -3, смещение — -3*0,1, а среднее смещение суммы баллов SCORAD — -2,81 ± 2,70. В обоих случаях модифицированный критерий Уилкоксона указывал на наличие статистической значимости при p = 0,0113 и p = 0,0103, доказывая не меньшую эффективность EHK02-01 по суммарному баллу SCORAD. Для каждого пациента и режима терапии определяли изменение общего балла SCORAD в процентах на момент V3 и V4 относительно V2. В группе EHK02-01 в момент заключительного визита у 35,38% пациентов зафиксировано улучшение на 50 — 75%, у 27,69% пациентов — улучшение 75 — 100%.
Общая оценка исследователем (IGA)
См. рисунок 4. На базовом уровне средний балл IGA в обеих группах терапии был сопоставим (EHK02-01: 2,78 ± 0,54; положительный контроль: 2,82 ± 0,58; критерий Уилкоксона при сравнении групп: p = 0,6514). В группе EHK02-01 средний балл IGA к визиту V3 снизился на 0,58 ± 0,73 ед. до 2,20 ± 0,77 (критерий Уилкоксона при сравнении V2 и V3: p < 0,0001), а к заключительному визиту — до 1,57 ± 1,07, т. е. среднее снижение в период V2 — V4 составило 1,22 ± 1,08 (критерий Уилкоксона при сравнении V2 и V4: p < 0,0001). В группе положительного контроля средний балл IGA к визиту V3 снизился на 0,51 ± 0,81 ед. до 2,31 ± 0,79, а к заключительному визиту — до 1,86 ± 1,03 (критерий Уилкоксона при сравнении V2 с V3 и V4 с V2: p < 0,0001). Существенных различий между группами терапии не наблюдали как при сравнении изменений за период V2 — V3 (нормальный критерий Уилкоксона при сравнении групп терапии: p = 0,3996), так и при сравнении изменений за период V2 — V4 (EHK02-01: -1,22 ± 1,08; положительный контроль: -0,95 ± 1,08; нормальный критерий Уилкоксона при сравнении групп терапии: p = 0,1357). Модифицированный критерий Уилкоксона при сравнении V4 был существенным (p = 0,0012), а при сравнении V3 — нет (p = 0,3996), что демонстрирует не меньшую эффективность EHK02-01 относительно контроля по баллу IGA в момент V4. На момент V4 оценка IGA «симптом отсутствует» или «почти отсутствует» была достигнута у 44,62% пациентов группы EHK02-01 и 35,39% пациентов группы контрольного средства.
Оценка зуда пациентами
См. рисунок 5. Для оценки тяжести зуда использовали визуальную аналоговую шкалу 0 — 10 см (0 = зуд отсутствует, 10 — максимально возможный зуд). На базовом уровне существенных различий между группами терапии не наблюдали (EHK02- 01: 46,78 ± 23,54 мм; положительный контроль: 47,72 ± 25,12 мм; критерий Уилкоксона при сравнении групп терапии: p = 0,9556). В группе EHK02- 01 зуд к визиту V3 снизился на 22,69 ± 26,64 мм до 24,09 ± 22,17 (критерий Уилкоксона при сравнении V2 и V3: p < 0,0001), а к заключительному визиту — до 22,80 ± 22,85, т. е. среднее снижение в период V2 — V4 составило 22,98 ± 26,39 (критерий Уилкоксона при сравнении V2 и V4: p < 0,0001). В группе положительного контроля зуд к визиту V3 снизился до 29,98 ± 23,61, а к заключительному визиту — до 24,80 ± 24,66 (критерий Уилкоксона при сравнении V2 с V3 и V4 с V2: p < 0,0001).
Используя нормальный критерий Уилкоксона существенных различий между группами терапии по среднему баллу зуда не наблюдали как при сравнении V2 с V3 (EHK02-01: -22,69 ± 26,64; положительный контроль: -17,74 ± 25,30; p = 0,0716), так, при сравнении V2 с V4 (EHK02-01: -23,98 ± 26,39; положительный контроль: -22,92 ± 25,87; p = 0,5153). Модифицированный критерий Уилкоксона при сравнении V3 был существенным (p = 0,0115), а при сравнении V4 — нет (p = 0,1688).
Оценка эффективности пациентами
Во время визитов V3 и V4 пациенты оценивали эффективность терапии исследования. На момент V3 пациенты в среднем оценили эффективность EHK02-01 на 2,58 ± 1,01, а эффективность положительного контроля — на 2,38 ± 0,93. На момент финального визита EHK02-01 получил оценку 2,74 ± 0,92, а положительный контроль 2,52 ± 1,09. При использовании нормального критерия Уилкоксона существенных различий в выставленном пациентами балле эффективности между группами терапии не наблюдали как на момент V3, так и на момент V4 (критерий Уилкоксона на момент V3: p = 0,1506; на момент V4: p = 0,0918). Оба модифицированных критерия Уилкоксона были статистически существенны (p < 0,0001), демонстрируя не меньшую эффективность EHK02-01 в сравнении с положительным контролем.
Безопасность
В целом оба испытуемых средства переносились хорошо, в ходе исследования у 6 (9,2%) пациентов зафиксировано 8 НЯ. У одного пациента зафиксировано 3 НЯ, у остальных — по одному. 2 НЯ пришлось на общие симптомы (бронхит и простуда), 1 местное НЯ (жжение) зафиксировано в обеих группах терапии, еще 2 местных НЯ пришлось на группу EHK02-01, а еще 3 — на группу положительного контроля. Точное описание НЯ отсутствует, поскольку НЯ были идентифицированы по опросникам, в которых пациенты оценили переносимость как «плохую» или «очень плохую». Во время визитов V3 и V4 пациентов попросили оценить переносимость и безопасность каждого испытуемого средства по 5-бальной шкале (1 = очень плохо, 2 = плохо, 3 = умеренно, 4 = хорошо, 5 = очень хорошо). Лишь небольшая доля пациентов оценили переносимость на «плохо» или «очень плохо» (EHK02-01: n = 2 в момент V3, n = 1 в момент V4; положительный контроль: n = 3 в момент V3, n = 1 в момент V4). Оба испытуемых средства переносились хорошо, существенных различий в отношении переносимости зафиксировано не было.
Дискуссия
Результаты данного рандомизированного, сравнительного, интраиндивидуального, двойного слепого многоцентрового исследования подтверждают, что средство EHK02 01 существенно снижало интенсивность клинических проявлений АД у пациентов с легким до умеренного АД при местном применении на пораженные участки, вне зависимости от способа оценки интенсивности таких проявлений (балл SCORAD, IGA, оценка со стороны пациента). Кроме того, согласно результатам интраиндивидуального сравнения, терапевтическая эффективность EHK02 01 существенно не отличалась от таковой положительного контроля, т. е. медицинского изделия с подтвержденной терапевтической эффективностью в отношении АД, которая, как предполагается, объясняется способностью средства улучшать функцию кожного барьера. Таким образом исследование подтверждает и расширяет сделанное ранее предположение, что средства на основе эктоина могут оказаться полезными при терапии АД [10]. Нам известно, что дизайн исследования ограничен отсутствием группы плацебо. При этом следует отметить, что эффективность, достигнутая при терапии EHK02-01, существенно не отличалась от эффективности, достигнутой при терапии положительным контролем, т. е. средством с подтвержденной эффективностью. Поскольку применение рецептурных препаратов зачастую ограничивается рисками, связанными с нежелательными явлениями, а также поскольку профиль безопасности кортикостероидов имеет определенные недостатки, в последние годы прилагается немало усилий для разработки новых средств, которые позволят снизить необходимость применения потенциально небезопасных веществ. В силу специфики заболевания, для контроля АД необходимо сочетать кратковременную терапию острых фаз, предполагающую применение нескольких средств, с длительной поддерживающей терапией, нацеленной на поддержание оптимального состояния кожи. Результаты данного исследования, а также практически полное отсутствие побочного действия эктоина на кожу человека [22-26], позволяет рассматривать EHK02-01 как идеальный вариант для долгосрочной поддерживающей терапии АД. Наше исследование не рассматривало механизм действия эктоина при АД. Предшествующие исследования продемонстрировали, что эктоин защищает кожный барьер от потери влаги, повышает гидрацию кожи, обладаю длительным увлажняющим действием [10]; таким образом возможно, что терапевтическое действие эктоина обусловлено способностью укреплять кожный барьер. Также эктоин продемонстрировал способность стабилизировать структуры клеточных мембран эпителиальных клеток человека, включая кератиноциты эпидермиса, предотвращая, таким образом, инициацию провоспалительных сигнальных каскадов, включая митоген-активируемые киназы, которые необходимы для экспрессии воспалительных молекул на поверхности кератиноцитов, включая фактор межклеточной адгезии-1 [27]. Эта адгезионная молекула является характерным признаком воспалительных заболеваний кожи, таких как псориаз и АД [28]. Исследования на животных подтверждают, что эктоин способен защищать от индуцируемого наночастицами нейтрофильного воспаления легких вне зависимости от времени применения эктоина (до или после введения наночастиц) [29, 30]. Совокупно эти исследования с высокой уверенностью позволяют говорить о наличии у эктоина противовоспалительных свойств.
Средства на основе эктоина могут представлять новый метод терапии легкого до умеренного АД. Учитывая документально подтвержденную информацию о том, что совместимые растворимые вещества в целом и эктоин в частности обладают крайне высокой биосовместимостью при практически полном отсутствии побочного действия [8], мы делаем предположение, что средства на основе эктоина идеально подходят для долгосрочной терапии АД. Принимая во внимание текущий алгоритм терапии АД мы предполагаем, что эктоин может занять место стандартной терапии между умягчающими средствами и специфическими противовоспалительными средствами, включая местные кортикостероиды и местные ингибиторы кальциневрина. Надеемся, что наши наблюдения послужат толчком для новых, более детальных и масштабных клинических исследований EHK02-01 как средства терапии АД и других воспалительных заболеваний кожи, сопровождающихся нарушением барьерной функции кожи.

Рисунок 1. Дизайн исследования Клиническое исследование подразумевало 2 периода и 4 визита. Во время первого визита осуществляли сбор демографических данных и проводили медицинский осмотр. После истечения периода 1 (период вымывания — 28 дней), все пациенты получили испытуемые средства. Оценку обрабатываемых испытуемыми средствами участков кожи проводили в начале исследования, а также через 7 и 28 дней после начала терапии.
.jpg)
Рисунок 2. Количество пациентов в выборках исследования. Совокупно в исследование было рандомизировано 65 пациентов. Выборка для оценки безопасности (ITT) составила 65 пациентов, в то время как количество пациентов, успешно завершивших исследование с выполнением требований протокола (выборка PP), составило 54 пациента. Существенные нарушения протокола выявлены у 11 пациентов.
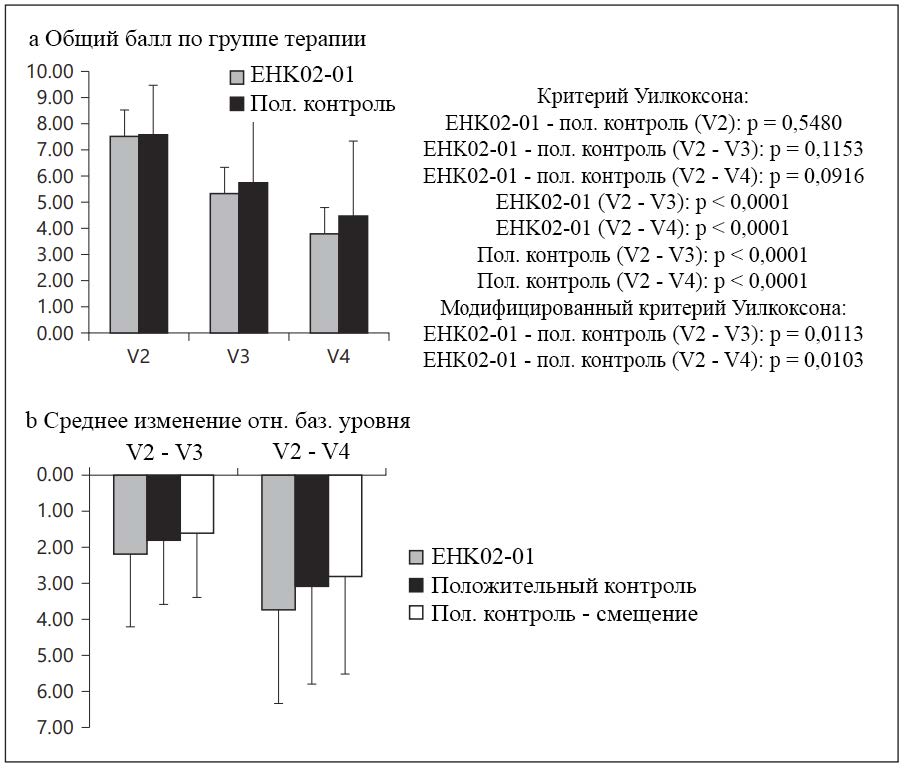
Рисунок 3. SCORAD. a На базовом уровне средние значения суммарного балла SCORAD в группе EHK02-01 и в группе положительного контроля были сопоставимы. В группе EHK02-01 среднее суммарного балла SCORAD снизилось с 7,51 ± 1,76 на базовом уровне до 5,32 ± 2,49 во время визита 3 (p < 0,0001) и до 3,77 ± 3,01 во время заключительного визита (p < 0,0001). В группе положительного контроля среднее суммарного балла SCORAD снизилось с 7,55 + 1,91 на базовом уровне до 5,74 ± 2,36 во время визита 3 (p < 0,0001) и до 4,45 ± 2,88 во время заключительного визита (p < 0,0001). Результаты по критерию Уилкоксона были статистически значимы. b Существенных различий между группами терапии по среднему значению изменения суммарного балла SCORAD не наблюдали как при сравнении периода V2 — V3 (p = 0,1153), так и при сравнении периода V2 — V4 (p = 0,0916). По модифицированному критерию Уилкоксона наблюдали смещение распределения разностей в группе положительного контроля, оба модифицированных критерия имели статистическую значимость (p = 0,0113 и p = 0,0103).
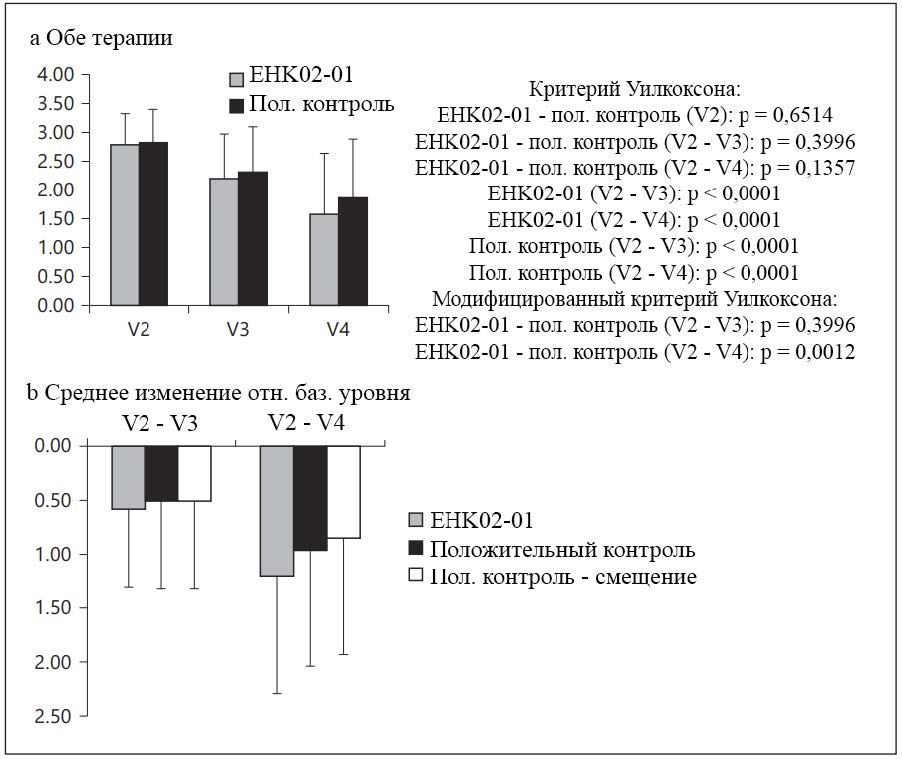
Рисунок 4. IGA. a На базовом уровне средние значения IGA в группе EHK02-01 и в группе положительного контроля были сопоставимы. В группе EHK02-01 среднее значение балла IGA снизилось с 2,78 ± 0,54 до 2,20 ± 0,77 во время визита 3 (p < 0,0001) и до 1,57 ± 1,07 (p < 0,0001) во время заключительного визита: средняя разность между V2 и V4 составила 1,22 ± 1,08. В группе положительного контроля среднее значение балла IGA снизилось до 2,31 ± 0,79 во время визита V3 (p < 0,0001) и до 1,86 ± 1,03 во время заключительного визита (p < 0,0001). Результаты по критерию Уилкоксона были статистически значимы. b Существенных различий между группами терапии по среднему значению изменения балла IGA не наблюдали как при сравнении периода V2 — V3 (p = 0,3996), так и при сравнении периода V2 — V4 (p = 0,1357). По модифицированному критерию Уилкоксона наблюдали смещение распределения разностей в группе положительного контроля. На момент заключительного визита модифицированный критерий имел статистическую значимость (p = 0,0012), в то время-ка на момент визита V3 — нет (p = 0,3996).
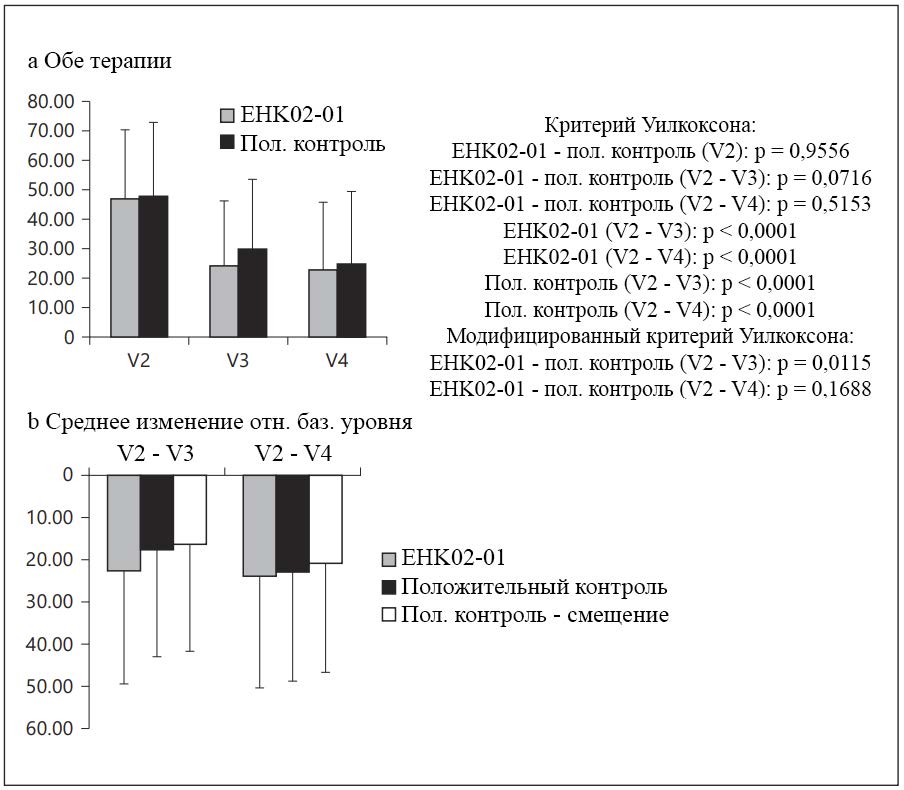
Рисунок 5. Оценка интенсивности зуда пациентами. a На базовом уровне средние значения интенсивности зуда в группах EHK02-01 и положительного контроля были сопоставимы (EHK02-01: 46,78 ± 23,54 мм; положительный контроль: 47,72 ± 25,12 мм). В группе EHK02-01 средний балл интенсивности зуда снизился на 22,69 ± 26,64 м до 24,09 ± 22,17 во время визита 3 (p < 0,0001) и до 22,80 ± 22,85 мм во время заключительного визита (p < 0,0001): средняя разница за период V2 — V4 составила 22,98 ± 26,39 мм. В группе положительного контроля средний балл интенсивности зуда снизился до 29,98 ± 23.61 во время визита V3 (p < 0,0001) и до 24,80 ± 24,66 во время заключительного визита (p < 0,0001). b Используя нормальный критерий Уилкоксона существенных различий между группами терапии по изменению балла интенсивности зуда не обнаружили как при сравнении за период V2 — V3 (EHK02-01: -22,69 ± 26,64; положительный контроль: -17,74 ± 25,30; p = 0,0716), так и при сравнении за период V2 — V4 (EHK02-01: -23,98 ± 26,39; положительный контроль: 22,92 ± 25,87; p = 0,5153). Модифицированный критерий Уилкоксона при сравнении V3 был существенным (p = 0,0115), а при сравнении V4 — нет (p = 0,1688).
Таблица 1. SCORAD
| Критерий | Интенсивность |
| Эритема | 0-3 |
| Отек/папулы | 0-3 |
| Кровоточивость / струпья | 0-3 |
| Экскориация | 0-3 |
| Лихенификация | 0-3 |
Таблица 2. IGA
| 0 | Отсутствует | Нет воспалительных признаков АД |
| 1 | Практически отсутствует | Едва заметное покраснение и едва заметная инфильтрация / образование папул |
| 2 | Легкая степень | Легкое покраснение и легкая инфильтрация / образование папул |
| 3 | Умеренная степень | Умеренное покраснение и умеренная инфильтрация / образование папул |
| 4 | Тяжелая степень | Тяжелое покраснение и тяжелая инфильтрация / образование папул |
| 5 | Крайне тяжелая степень | Крайне тяжелое покраснение и крайне тяжелая инфильтрация / образование папул |
| Интенсивность: 0 = отсутствует, 1 = легкая степень, 2 = умеренная степень, 3 = тяжелая степень. | ||
Таблица 3. Оценка эффективности пациентами
| Балл | Описание |
| 1 | Не помогло |
| 2 | Немного помогло |
| 3 | Хорошо |
| 4 | Очень хорошо |
Таблица 4. Размер пораженных участков
| N | Среднее | СКО | Мин | Медиана | Макс | |
| EHK02-01 | 65 | 62,52 | 50,18 | 12,00 | 42,00 | 247,00 |
| Положительный контроль | 65 | 58,64 | 46,57 | 11,30 | 40,60 | 201,50 |
